基因治疗临床应用的现状及展望
2019-05-27 15:10:08 浏览:14540 来源: 中国食品药品监管杂志v

【编者按】
在现阶段,基因治疗无疑是一把双刃剑,并且由于该领域的不成熟性,在快速推进与保障安全性之间尚未找到理想的平衡点。但在关注风险的同时,更应该看其治疗成效。近年来,中国始终都在努力推动国内产业走上国际舞台。在基因治疗领域,激进也好,保守也罢,终极目的都是推动人类的健康良性发展。
——摘自《知识分子》公众号
基因治疗是指通过修改或操纵基因表达或改变活细胞的生物学特性,从而实现治疗或治愈疾病目标的技术。主要作用机制涉及以下几种:用健康的基因拷贝替代致病基因,灭活导致功能不正常的致病基因,将新的或修饰的基因引入体内以帮助治疗疾病等。目前,基因治疗产品正用以治疗包括癌症、遗传疾病和传染病在内的一系列疾病[1]。
近三年来,各种基因治疗进入临床试验的消息层出不穷,相关初创企业也获得不菲投资,不断发展壮大。特别是在美国鼓励罕见病药物研发的政策环境下,作为最容易被基因治疗技术攻克的疾病领域之一,大多数单基因遗传罕见病基因治疗药物的研发也取得了重要进展。
本文将回顾当前基因治疗临床应用现状,重点探讨该技术在未来发展的机遇与挑战。
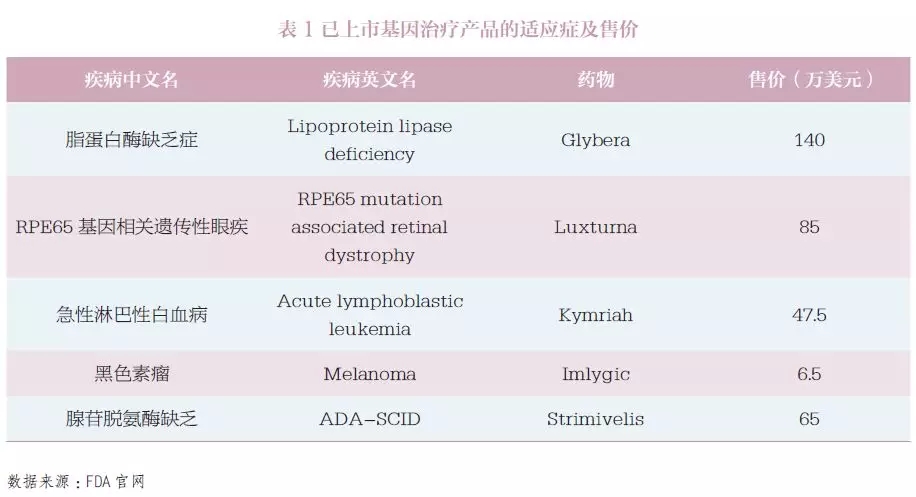
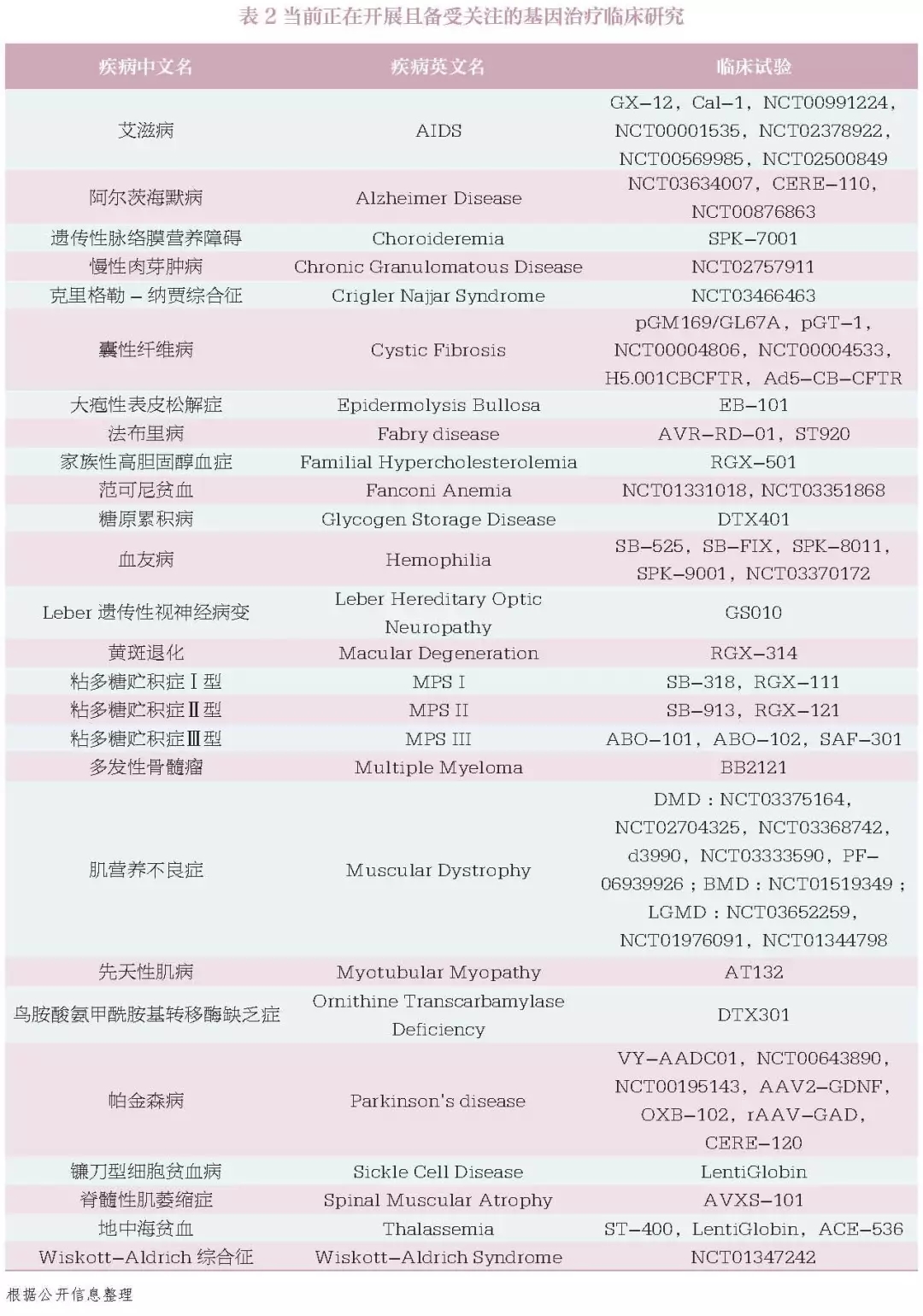
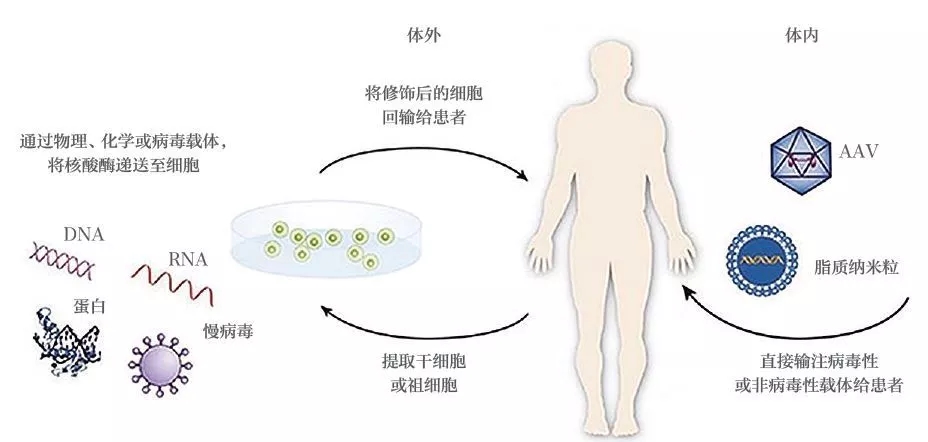
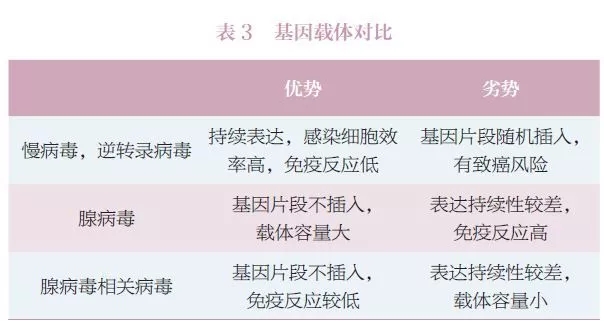
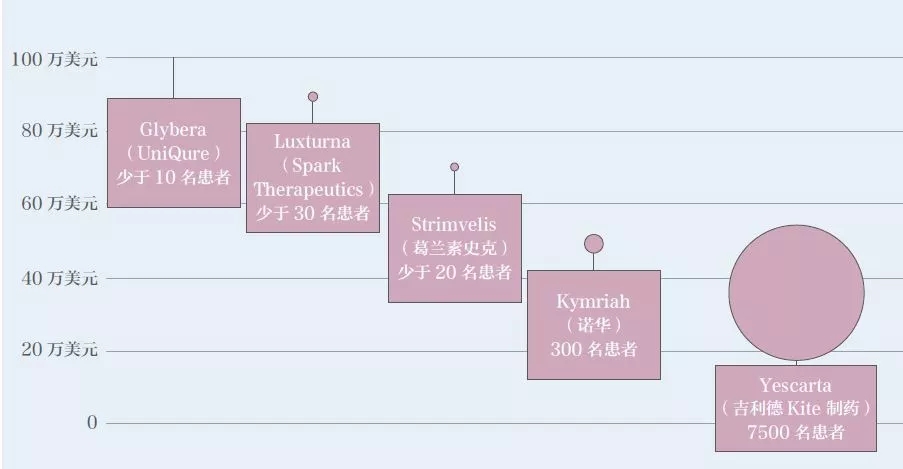
基因治疗的临床应用现状 迄今为止,全球仅有数款基因治疗药物上市。2015 年,欧盟批准首款基因治疗产品为用于治疗脂蛋白脂酶缺乏症的Glybera。2017 年底,美国批准的首款药品是用于治疗急性淋巴性白血病的Kymriah,同年批准了治疗遗传性眼疾的Luxturna。已上市产品适应证及售价如表1所示。 据2018 年5 月研究结果显示[1],当时已经有2600 项基因治疗的临床试验在进行中或者已经完成。这些临床试验集中在三大类疾病。第一类是单基因遗传病(如血友病,戈谢氏病),第二类是多基因疾病(如癌症),第三类是传染病(如艾滋病)。目前正在开展且备受关注的疾病如表2所示(癌症相关研究多达数百项,在此不再赘述)。 可以说,基因治疗的临床应用前景广阔,未来将会有越来越多的临床试验开展并进入临床应用。 图1 基因治疗产品分类[1] 数据来源:FDA 官网 基因治疗的作用机制 基因治疗产品包括以下几种:①质粒DNA,可以对环状DNA分子进行基因工程修改,将治疗基因携带到人体细胞中。②病毒载体,病毒具有将遗传物质传递到细胞中的天然能力,因此一些基因治疗产物来自病毒。一旦病毒被修饰以消除其引起传染病的能力,这些经修饰的病毒可用作载体将治疗基因携带到人体细胞中。③细菌载体,细菌可以被修饰以防止它们引起传染病,然后用作载体将治疗基因携带到人体组织中。④人类基因编辑技术,基因编辑的目标是破坏有害基因或修复突变基因。⑤源自患者的细胞基因治疗产品,从患者体内取出细胞,进行遗传修饰(通常使用病毒载体),然后返回患者体内。 按照基因改变发生的时机,通常分为两大类(图1):体外(exvivo)和体内(invivo)。体外是通过修复体外培养细胞的基因,再将修复后的细胞输入到人体,而体内则是直接将能够改变基因的物质通过载体输入到人体。 由于病毒能够高效地进入细胞,目前多数基因疗法使用改造后的病毒作为载体。在过去几十年的研究中,科学家使用过不同的改造病毒载体。早期的有逆转录病毒(retrovirus)和慢病毒(lentivirus),这两种病毒可以将正确基因插入到人体细胞的DNA中。但由于这种插入随机性较大,如果插入其他正常基因中会导致该基因失活甚至癌症。早期的基因治疗临床试验中有几名患者因此患上了白血病[2]。随后,科学家又研发了腺病毒(adenovirus)载体。腺病毒载体不会将基因插入到人体细胞的DNA中,而是会通过载体自己的方式在人体细胞中表达其携带的正确基因,因此较为安全。但是,腺病毒会引起较强的免疫反应。1999年一名患者因此在临床试验中去世[3],也是基因治疗技术的发展一度陷入冰点。随着科学技术的发展,新一代病毒载体-腺病毒相关病毒(AAV),又给基因疗法带来了希望。AAV通常不会将基因片段插入到人体细胞的DNA中,而且引起的免疫反应也比较低。因此,AAV是当前基因治疗使用的主要载体(表3)。 目前,基因编辑是基因治疗中研究热度最高、应用前景最为广阔的技术。该技术利用基因编辑工具CRISPR 或者锌指核酸酶(ZFN)[4-5],定点将修复基因插入到细胞的DNA 中。这一技术的优势在于既避免了随机插入基因带来的风险,又能通过修复或者插入保证治疗效果的持续性。 需要说明的是,基因疗法不要把所有细胞修改。很多疾病只需要让一部分细胞表达正确蛋白即可。以酶缺乏导致的溶酶体病为例,这些酶通常会被细胞分泌到细胞外,如果有一部分细胞高效表达酶,这些细胞会分泌出大量的酶到细胞外,进入血液,再通过血液循环输送到全身其他细胞从而起到治疗效果。在局部给药领域,基因疗法也展示出了广阔的应用前景,如FDA 批准用于治疗遗传性眼疾的基因治疗药物Luxturna,只需要眼睛的部分细胞可以表达原本缺乏的酶(由AAV 载体引入)即可。 基因治疗临床应用的展望 目前,有患者寄望于利用基因治疗来治愈疾病,甚至在不了解风险的情况下贸然参与相关临床研究,在当前基因治疗相关临床研究很少获得监管部门许可的情况下,患者要承担巨大的风险。因此,让患者了解基因治疗在当前临床应用的真实效果和持续时间,对患者很有必要,同时监管部门也应及时提示相关产品的治疗风险。 在治疗效果方面,疾病已经造成的损伤很难逆转。学术界有人在研究宫内基因治疗(inuterogenetherapy)[6],也就是从胎儿阶段就进行基因治疗,从而避免难以逆转的损伤。患者对治愈的期待往往会要求回复到与常人一样,这种改变难度极大。尽管目前来看,基因治疗的确比常规疗法有一些优势,但离绝对的治愈还有较远的距离。 在持续时间方面,目前基因治疗多数采用AAV载体在体内表达正确的基因,通过产生正确的蛋白发挥疗效,并非真正意义上的基因编辑。对前者而言,随着细胞的分裂和免疫系统的运作,AAV会逐渐在体内消失,因此这种基因疗法的持久性是很大一个问题,理论上并不能疗效持续终身[7]。实际上,很多实验室在研究如何进行AAV多次注射。 而基因编辑是将正确基因片段插入到细胞的DNA中或者在原位置修复基因突变。这种方法的优势在于被修改后的基因会随着细胞分裂而复制,从而长久保存下去。理论上基因编辑的疗效可以持续终身,但这一点还需要临床试验来验证。 对于监管部门而言,FDA如实提示患者:基因治疗产品由FDA的生物制品评估和研究中心(CBER)监管。所有基因治疗项目在人体中的临床研究在美国启动之前都需要提交研究性新药申请(IND),并且销售此类产品前需要提交和批准生物制剂许可申请(BLA)。FDA提示消费者,目前市面上已经存在用于自我管理的基因治疗产品和“自己”的试剂盒,但出售这些产品是违法的,患者需要确保正在考虑参与的任何基因治疗已经获得FDA批准,或者正在接受适当的监管监督。 在治疗风险方面,致癌风险、免疫反应、基因编辑的脱靶效应和生殖细胞DNA被改变,这些风险需要各利益相关方的密切注意。 ▷1◁ 致癌风险 基因治疗的病毒载体有可能插入并激活人体的原癌基因,从而导致癌症的发生。2003年,在一项针对严重复合型免疫缺乏症(SCID)的基因治疗临床试验中,2名受试者在注射药物后患上了白血病。试验中使用的是逆转录病毒,该病毒会将DNA片段随即插入到人体细胞中,如果刚好激活了原癌基因,便会导致癌症。目前,基因治疗的动物实验中一个重要检测指标即为药物的致癌风险。 ▷2◁ 免疫反应 基因治疗使用的病毒载体和表达的外源基因都有可能引起免疫反应。1999年在一项宾夕法尼亚大学开展的针对鸟胺酸氨甲基转移酶缺乏症的基因治疗临床试验中,JesseGelsinger死于对基因治疗药物的强免疫反应。在注射腺病毒载体4天之后,Jesse死于免疫反应导致的器官衰竭和脑死亡。新一代的基因治疗使用的是腺病毒相关病毒(AAV),免疫原性和安全隐患大幅度降低。不过由于人在生活中经常接触到AAV,多数人已经有针对AAV的抗体存在,因此在临床试验时会首先检测对AAV的免疫反应以确保安全性。 ▷3◁ 基因编辑的脱靶效应 目前基因治疗中涌现出一个新的大类,基因编辑。目前主要有两种基因编辑工具在临床试验阶段:ZFN和CRISPR。基因编辑在基因治疗领域的应用主要是原位修复基因突变,或者于安全港湾(SafeHarbor)插入正确基因。但一个重要的问题是脱靶效应,也就是基因编辑工具在其他位置进行编辑造成一些不必要的DNA修改。如果激活了原癌基因会导致癌症,如果改变了其他重要基因的正常运作也会导致很严重的问题。现在的基因编辑的动物实验一个重要的安全指标就是通过深度测序(deepsequencing)检测脱靶效应。 脱靶效应可以理解为,基因编辑工具通过识别某些特殊的DNA序列从而在指定的位置进行修复,但是人类的基因组这么大,从概率学上,同样或者类似的DNA序列完全可能出现在其他基因处。 ▷4◁ 生殖细胞DNA被改变 学术上称为生殖遗传(germlinetransmission),主要指基因治疗的载体将DNA片段插入到生殖细胞的DNA中,而这会导致产生的精子或者卵细胞携带同样的插入片段[8]。这也将直接影响到下一代的DNA。即使这些插入片段对人体没有任何影响,在伦理学上也是一大疑问。在基因治疗的研究中通常会重点测试该药物对生殖细胞DNA的影响。但相对前面三点,这一点的重要性相对低一些。 基因治疗的价格 基因治疗以其光明的前景吸引了全世界科学家和患者的关注,国内患者也期待该项技术能够早日落地中国,但其高昂的定价令人望而却步。 数据显示,基因治疗的价格普遍较高(约100万美元),甚至有的药企计划要价400到500万美元[9]。由于药物研发的成本相对固定,患者人群的数量通常会决定分担成本的多少(图3)。例如开发一种常见病的药物支出是1亿美元,一种罕见病药物的支出是5000万美元。常见病的患者有10万人,那每位1000元即可收回成本。而罕见病患者可能只有100人,那每位要50万元才能收回成本。 图3 基因治疗费用与患者人数的关系(每年) 数据来源:www.technologyreview.com 上述价格为基因治疗产品在欧美国家医保报销体系下的定价。如在美国,粘多糖症的基因治疗药物预计售价为100万美元,支持该价格的关键在于基因治疗可以取代现有的干细胞移植,而干细胞移植的价格是100万美元,所以基因治疗药物自然可以有相近的价格。照此逻辑,以中国的人口基数及发病率计算,该药物定价可为数十万元,但这很可能使药企无法收回成本。因此,现在很难预测基因治疗在中国的定价,影响价格的素有很多(如医保,患者人数和药企成本等)。